辦理條件
1、廣東省藥品監(jiān)督管理局發(fā)放的醫(yī)療器械注冊證書(體外診斷試劑),注冊證書在有效期內。
2、注冊證書載明的注冊人名稱和住所、代理人名稱和住所發(fā)生變化的,注冊人應當向原注冊部門申請登記事項變更;境內體外診斷試劑生產地址變更的,注冊人應當在相應的生產許可變更后辦理注冊登記事項變更。3、納入廣東省醫(yī)療器械注冊人制度試點的注冊申請人還應同時符合以下條件:
(1)住所位于廣州、深圳、珠海市轄區(qū)范圍內,可以是企業(yè)、研發(fā)機構和科研人員?
(2)委托在廣東省行政區(qū)域內依法設立的企業(yè)生產本產品;
(3)應當配備專職的法規(guī)事務、質量管理、上市后事務等相關人員,以上人員應具有相應的專業(yè)背景和工作經驗;
(4)具備醫(yī)療器械全生命周期管理能力,有對質量管理體系進行評估、審核和監(jiān)督的人員和條件;?
(5)具備承擔醫(yī)療器械質量安全責任的能力,確保研制過程規(guī)范,所有數據真實、完整、可追溯。
(6)質量誠信良好,未有失信記錄,未被納入廣東省藥品監(jiān)管“黑名單”。
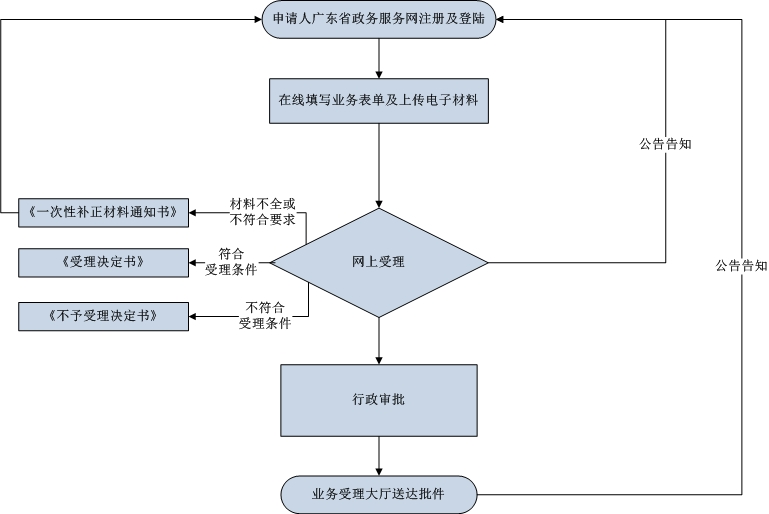
辦理流程
申請材料
證明性文件
體外診斷試劑注冊變更申請表
注冊人關于變更情況的聲明
原醫(yī)療器械注冊證及其附件的復印件、歷次醫(yī)療器械注冊變更文件復印件
關于變更情況的申報資料要求
符合性聲明
告知承諾制審批承諾書
申請材料形式標準
(1)申請材料應清晰、整潔,使用A4規(guī)格紙張打印
(2)每項文件第一頁作標簽,或用帶標簽的隔頁紙分隔,并按資料目錄標明項目編號
(3)每項文件均應加蓋企業(yè)公章
(4)按照申請材料目錄的順序裝訂成冊。
申報資料的具體要求
(1)申請表
(2)證明性文件
(a)企業(yè)營業(yè)執(zhí)照副本復印件
(b)組織機構代碼證復印件
(3)申請人關于變更情況的聲明
(4)原醫(yī)療器械注冊證及附件復印件、歷次醫(yī)療器械注冊變更文件復印件
(5)關于變更情況相關的申報資料要求
(a)注冊人名稱變更:企業(yè)名稱變更核準通知書(境內注冊人)和/或相應詳細變更情況說明及相應證明文件。
(b)注冊人住所變更:相應詳細變更情況說明及相應證明文件。
(c)境內醫(yī)療器械生產地址變更:應提供相應變更后的生產許可證。
(6)符合性聲明
a.注冊人聲明本產品符合《體外診斷試劑注冊管理辦法》和相關法規(guī)的要求;聲明本產品符合現(xiàn)行國家標準、行業(yè)標準,并提供符合標準的清單。
b.注冊人出具所提交資料真實性的自我保證聲明。
辦理依據
1、《體外診斷試劑注冊管理辦法》 第五十八條、 第六十條、 第六十一條
2、《醫(yī)療器械監(jiān)督管理條例》 第十四條
辦理時限說明
法定期限:登記事項變更資料符合要求的,食品藥品監(jiān)督管理部門應當即時辦理。(《醫(yī)療器械監(jiān)督管理條例》第十四條規(guī)定已注冊的第二類、第三類醫(yī)療器械產品發(fā)生非實質性變化,不影響該醫(yī)療器械安全、有效的,應當將變化情況向原注冊部門備案)
承諾期限:登記事項變更資料符合要求的,食品藥品監(jiān)督管理部門應當即時辦理。(《醫(yī)療器械監(jiān)督管理條例》第十四條規(guī)定已注冊的第二類、第三類醫(yī)療器械產品發(fā)生非實質性變化,不影響該醫(yī)療器械安全、有效的,應當將變化情況向原注冊部門備案)